טירוזין קינאז
מה זה טירוזין קינאז?
טירוזין קינאז היא קבוצה ספציפית של אנזימים המוקצים תפקודית לקינאזות חלבון מנקודת מבט ביוכימית. קינאזות חלבון מעבירות הפיך (אפשרות לתגובה הפוכה) קבוצות פוספט לקבוצת OH (קבוצת הידרוקסיל) של חומצת האמינו טירוזין. קבוצת הפוספט מועברת לקבוצת ההידרוקסיל של טירוזין של חלבון אחר.
באמצעות זרחן זה הפיך המתואר, טירוזין קינאזים יכולים להשפיע באופן מכריע על פעילותם של חלבונים ולכן יש להם תפקיד חשוב במסלולי הולכת האות. טיפולי במיוחד, כמו באונקולוגיה הפונקציה של טירוזין קינאזים משמשת כמטרה לתרופות.

המשימה והפונקציה
תחילה צריך להיות מחולק לטירוזין קינאזים לטירוזין קינאזים, שאינם קשורים לממברנה, על מנת להבין כיצד הם מתפקדים.
טירוזין קינאזות קשורות ממברנה יכולות להיות בעלות פעילות קינאזית חלבונית משלהן, ותפקוד הקינאז מופעל כחלק ממתחם הקולטן על קרום התא. אחרת, ניתן לקשר פונקציונלית לקומפלקס הקולטן באופן פונקציונלי עם טירוזין קינאזות, אך לא ניתן לאתר בו ישירות. כאן הטירוזין קינאז והקולטן יוצרים קשר דרכו מועבר אות מסוים לקינאז דרך הקולטן.
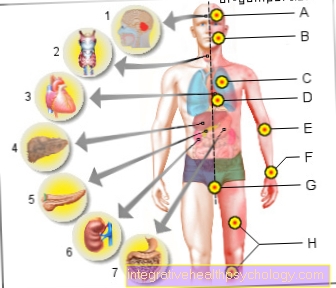
במקרה של טירוזין קינאז שאינה קשורה לקרום, זה בציטופלסמה או בגרעין התא. ניתן למנות דוגמאות שונות של טירוזין קינאזות בהתאם לתכנון המבני עם פונקציה נלווית. דוגמאות ל טירוזין קינאזות קשורות ממברנה הן קולטן האינסולין, קולטן EGF, קולטן NGF או קולטן PDGF. זה מראה כי מפל האות בעזרת טירוזין קינאזות הם תהליכים חיוניים בגוף האדם.
שחרור האינסולין מהלבלב בקשר לארוחות מוסדר באמצעות קולטן האינסולין. לקולט EGF אתרים קשורים ספציפיים למספר ליגנדים, בהם שווה להזכיר EGF או TNF-alpha. כליגנד חלבון, ה- EGF (גורם צמיחת האפידרמיס) מקבל תפקיד יוצא דופן כגורם גדילה (התפשטות והתמיינות תאים). לעומת זאת, TNF-alpha הוא אחד הסמנים המקדמים את הדלקת בגוף האדם וממלא תפקיד אבחוני חשוב באבחון הדלקת.
ה- PDGF, בתורו, הוא גורם גדילה שמשתחרר על ידי תרומבוציטים (טסיות דם) אשר גורם לסגירת פצעים ועל פי המחקר הנוכחי, תורם גם להתפתחות יתר לחץ דם ריאתי.
דוגמאות לטינוזינים קינאזים שאינם קשורים לממברנה הם ה- ABL1 וה- Janus Kinases.
באופן עקרוני מפל איתות עם מידע מסוים תמיד מתרחש באותו אופן סטריאוטיפי במקרה של טירוזין קינאז. ראשית, ליגנד מתאים חייב להיקשר לקולטן, הנמצא בדרך כלל על פני תאים. קישור זה נוצר בדרך כלל באמצעות מבנה חלבון מתואם של ליגנד וקולטן (עיקרון נעילה ומפתח) או באמצעות קשירה לקבוצות כימיות מסוימות של הקולטן (קבוצות פוספט, סולפט וכו '). הצמדה משנה את מבנה החלבון של הקולטן. במקרה של טירוזין קינאזים בפרט, הקולטן יוצר הומודימרים (שתי יחידות-חלבון זהות) או הטרודימרים (שתי יחידות-חלבון שונות). דימריזציה כביכול זו יכולה להוביל להפעלה של טירוזין קינאזות שכאמור ממוקמים ישירות בקולטן או בצד הציטופלסמי (מכוון אל פנים התא) של הקולטן.
ההפעלה מקשרת בין קבוצות ההידרוקסיל של שאריות טירוזין של הקולטן לבין קבוצות פוספט (זרחן). זרחן זה יוצר אתרי זיהוי של חלבונים מקומיים תאיים שיכולים להיקשר אליהם לאחר מכן. הם עושים זאת באמצעות רצפים ספציפיים (תחומי SH2). לאחר הכריכה לקבוצות הפוספטים, מפעילים גרעיני איתות מורכבים ביותר בגרעין התא, מה שמביא בתורו לזרחן.
יש לציין כי ניתן להשפיע על פעילותם של חלבונים לשני הכיוונים באמצעות זרחן על ידי טירוזין קינאזים. מצד אחד ניתן להפעיל אותם, מצד שני ניתן גם לבטל אותם. ניתן לראות כי חוסר איזון בפעילות טירוזין קינאז יכול להוביל להעלמת יתר של תהליכים הקשורים לגורם גדילה, מה שמאפשר בסופו של דבר לתאי הגוף להתרבות ולהבדיל (אובדן של חומר גנטי תאי). אלה התהליכים הקלאסיים של התפתחות הגידול.
מנגנוני רגולציה פגומים של טירוזין קינאזים ממלאים גם הם תפקיד מכריע בהתפתחות סוכרת (קולטן אינסולין), טרשת עורקים, יתר לחץ דם ריאתי, צורות מסוימות של לוקמיה (במיוחד CML) או סרטן ריאות לא-קטן תאים (NSCLC).
גלה את כל הנושא כאן: מחלות גידולים.
מהו הקולטן לטירוזין קינאז?
קולטן טירוזין קינאז הוא קולטן מבוסס ממברנה, כלומר קולטן המעוגן בקרום התא. מבחינה מבנית זהו קולטן בעל קומפלקס טרנסממברנה. המשמעות היא שהקולטן מושך את כל קרום התא ובנוסף יש לו צד חוץ ותוך תאי.
בצד החוץ תאי, יחידת האלפא, הליגנד הספציפי נקשר לקולטן, ואילו המרכז הקטליטי של הקולטן נמצא בצד התוך תאי, ß- תת היחידה. המרכז הקטליטי מייצג את האזור הפעיל של האנזים, בו מתרחשות תגובות ספציפיות.
כפי שכבר הוזכר לעיל, מבנה הקולט מורכב בדרך כלל משתי יחידות תת חלבון (דימר).
עם קולטן האינסולין למשל שתי יחידות האלפא-אלפא מחברות את האינסולין הליגנד. לאחר קשירת ליגנד, קבוצות פוספט (מה שנקרא זרחן) קשורות לשאריות טירוזין ספציפיות (קבוצות הידרוקסיל). זה יצר את פעילות טירוזין קינאז של הקולטן.בהמשך ניתן להפעיל או להפעיל חלבוני מצע נוספים (למשל אנזימים או ציטוקינים) בתוך התא באמצעות זרחן מחודש, ובכך להשפיע על התפשטות והתמיינות התא.
מהו מעכב טירוזין קינאז?
מה שמכונה מעכבי טירוזין קינאז (גם: מעכבי טירוזין קינאז) הם תרופות חדשות יחסית שניתן להשתמש בהן לטיפול ספציפי בפעילות טירוזין קינאז. הם משויכים לתרופות הכימותרפיות ומקורם בסוף שנות התשעים ותחילת שנות האלפיים. ניתן לסווג אותם לדורות שונים ומשמשים לטיפול במחלות ממאירות.
באופן פונקציונלי ניתן למנוע תהליכים ספציפיים על ידי פעילויות טירוזין קינאז לא מאוזנות. באופן עקרוני, קיימים כאן ארבעה מנגנוני פעולה שונים. בנוסף להתחרות ב- ATP, קיימת אפשרות גם לקשירה ליחידת הזרחניים של הקולטן, למצע או לאוסטרולוגית מחוץ למרכז הפעיל. פעולתם של מעכבי טירוזין קינאז מופעלת על ידי קשירה לקולטן EGF ועל ידי עיכוב הפעילות האנזימטית של טירוזין קינאזים.
בהיסטוריה הרפואית, גילוי החומר הפעיל imatinib כמעכב טירוזין קינאז השיג עמדה יוצאת דופן. הוא משמש באופן ספציפי בלוקמיה מיאלואידית כרונית (CML), שם הוא מדכא את פעילות טירוזין קינאז שנוצרת פתולוגית על ידי היתוך כרומוזום (כרומוזום פילדלפיה על ידי היתוך של כרומוזום 9 ו 22).
בשנים האחרונות פותחו מספר מעכבי טירוזין קינאז נוספים. הדור השני הקיים כיום מכיל כעשרה מעכבי טירוזין קינאז.
קרא עוד על הנושא כאן:
- כימותרפיה ממוקדת עם מעכבי טירוזין קינאז
- לוקמיה מיאלואידית כרונית.
לאילו אינדיקציות משתמשים בהן?
מעכבי טירוזין קינאז משמשים למחלות ממאירות שונות. אימטיניב משמשת במיוחד בלוקמיה מיאלואידית כרונית. שימושים אפשריים אחרים הם סרטן ריאות תאים לא קטן (NSCLC), סרטן שד וסרטן המעי הגס.
בשל מנגנון ההתקפה הסלקטיבי מאוד של מעכבי טירוזין קינאז, הם בדרך כלל נסבלים טוב יותר מאשר חומרים כימותרפיים קונבנציונליים. עם זאת, יש לצפות גם כאן לתופעות לוואי.
למידע נוסף על: סרטן ריאות.